Потребность в терапии
В настоящее время для терапии ХМЛ применяются ингибиторы тирозинкиназы Abl, причем для терапии первичных пациентов одобрено уже 3 таких ингибитора (иматиниб, дазатиниб и нилотиниб) и еще один — бозутиниб — имеет высокие шансы быть одобренным. Тем не менее, несмотря на высокую эффективность препаратов в первой линии терапии, небольшая часть пациентов может приобретать резистентность непереносимость, требующую смены препарата. За счет высокой выживаемости пациентов с ХМЛ (медиана более 10 лет) со временем количество таких события нарастает и пациенты могут переходить на 3-ю и более поздние линии терапии. Эффективность препаратов в этой линии терапии уже значительно ниже, что представляет собой важную медицинскую проблему. Также пациенты могут приобретать мутацию T315I в терапии которой в настоящее время эффективен только препарат 3-го поколения понатиниб, который, однако, обладает серьезными побочными эффектами (тромботические и сердечнососудистые события и т. д.). — PF-114.
Таким образом, терапия ХМЛ в 3-й линии и в пациентах с мутацией T315I требует более эффективного и безопасного препарата в дополнение к уже имеющимся. На удовлетворение этой потребности направлен новый селективный ингибитор 3-го поколения Abl — PF-114.
Таким образом, терапия ХМЛ в 3-й линии и в пациентах с мутацией T315I требует более эффективного и безопасного препарата в дополнение к уже имеющимся. На удовлетворение этой потребности направлен новый селективный ингибитор 3-го поколения Abl — PF-114.
Потребность в терапии
В настоящее время для терапии ХМЛ применяются ингибиторы тирозинкиназы Abl, причем для терапии первичных пациентов одобрено уже 3 таких ингибитора (иматиниб, дазатиниб и нилотиниб) и еще один — бозутиниб — имеет высокие шансы быть одобренным. Тем не менее, несмотря на высокую эффективность препаратов в первой линии терапии, небольшая часть пациентов может приобретать резистентность непереносимость, требующую смены препарата. За счет высокой выживаемости пациентов с ХМЛ (медиана более 10 лет) со временем количество таких события нарастает и пациенты могут переходить на 3-ю и более поздние линии терапии. Эффективность препаратов в этой линии терапии уже значительно ниже, что представляет собой важную медицинскую проблему. Также пациенты могут приобретать мутацию T315I в терапии которой в настоящее время эффективен только препарат 3-го поколения понатиниб, который, однако, обладает серьезными побочными эффектами (тромботические и сердечнососудистые события и т. д.). — PF-114.
Таким образом, терапия ХМЛ в 3-й линии и в пациентах с мутацией T315I требует более эффективного и безопасного препарата в дополнение к уже имеющимся. На удовлетворение этой потребности направлен новый селективнй ингибитор 3-го поколения Abl — PF-114.
Таким образом, терапия ХМЛ в 3-й линии и в пациентах с мутацией T315I требует более эффективного и безопасного препарата в дополнение к уже имеющимся. На удовлетворение этой потребности направлен новый селективнй ингибитор 3-го поколения Abl — PF-114.

Наше решение
PF-114 представляет собой низкомолекулярный ингибитор Abl 3-го поколения, который, в отличие от понатиниба, имеет меньше побочных киназных мишеней, что позволяет рассчитывать на повышенную безопасность PF-114 при сохранении эффективности, в том числе в отношении мутантной формы T315I.
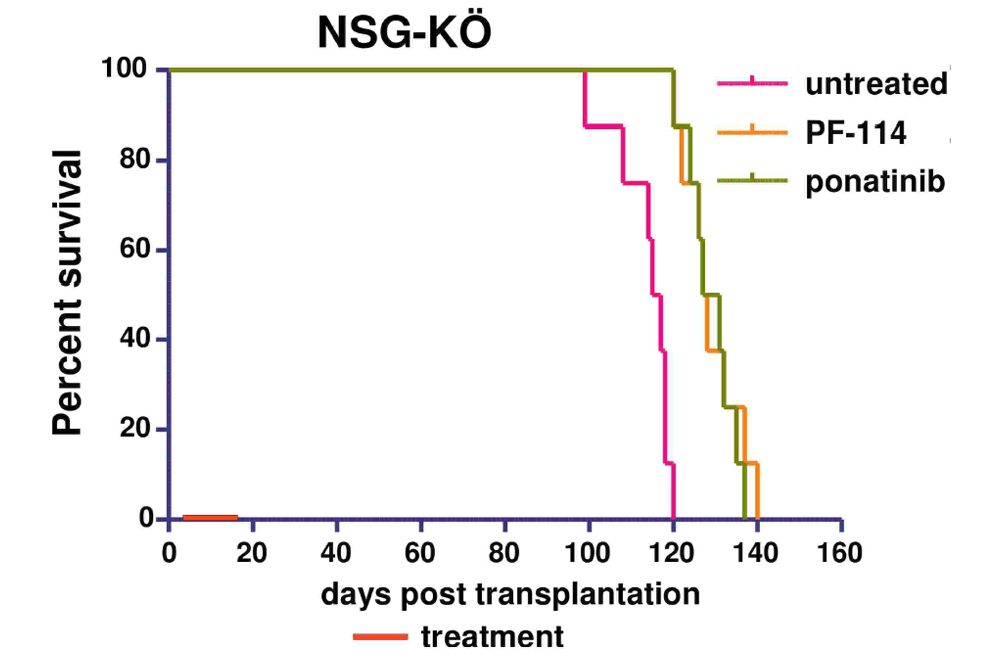
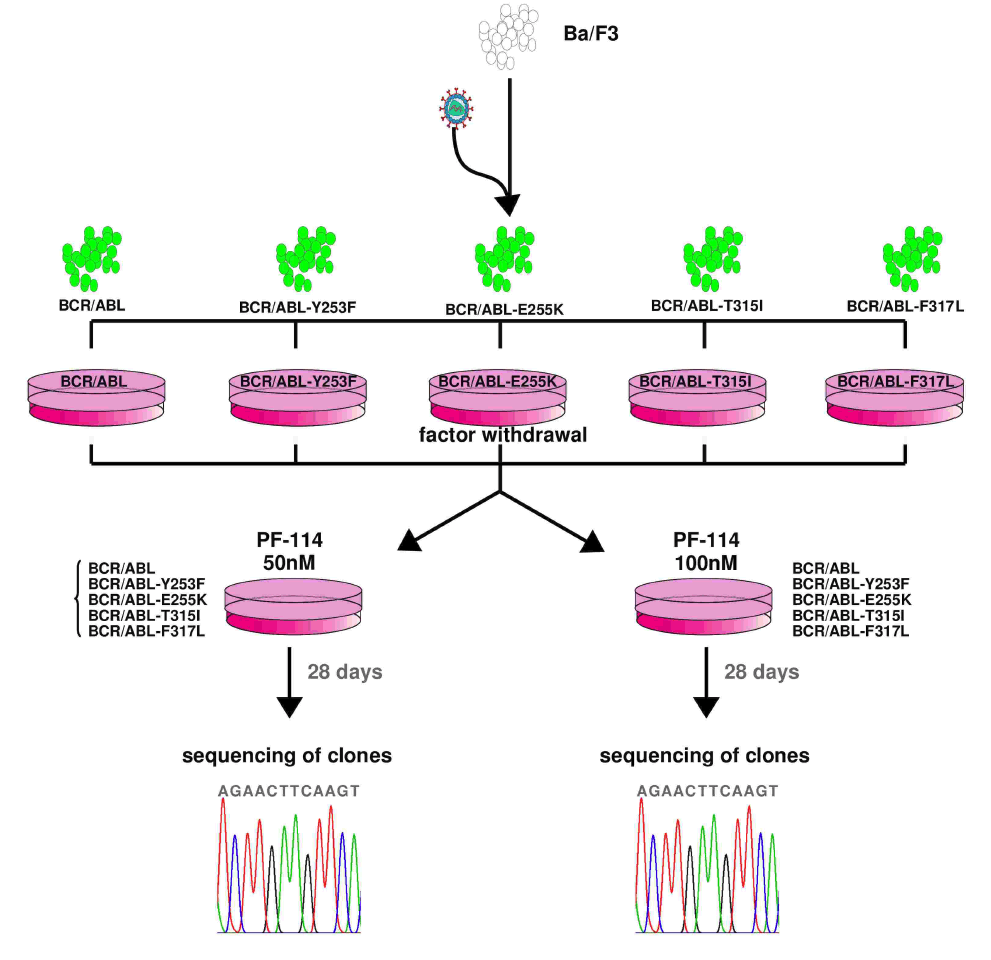
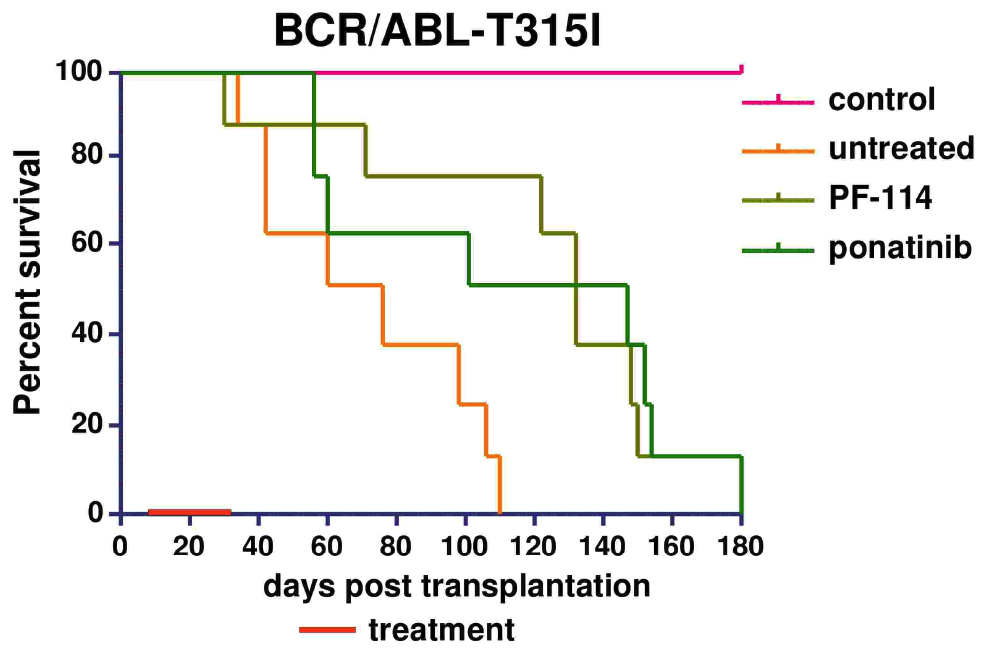
В многочисленных доклинических экспериментах была показана эффективность PF-114 в отношении ингибирования Abl и различных мутантных форм, включая T315I, подавление процесса возникновения новых мутаций в модельных in vitro системах, эффективность в животных моделях ХМЛ и Ph+ ОЛЛ с нативной формой Abl и мутацией T315I.
План разработки
Клиническая разработка препарата PF-114 включает в себя 1-ю фазу клинических исследований (проводится в настоящий момент), в ходе которой исследуется эффективность, безопасность, фармакокинетика разных доз препарата в пациентах с резистентными формами ХМЛ, в том числе с мутацией T315I. В дальнейшем планируется проведение многоцентрового международного клинического исследования 2-й фазы по показанию ХМЛ в 3-й линии терапии и с мутацией T315I. Дополнительно могут быть проведены исследования 2-й фазы по показаниям ХМЛ в продвинутых фазах (акселерации и бластного криза) а также Ph+ острого лимфобластного лейкоза.


Публикации
Mian AA, Rafiei A, Haberbosch I et. al. PF-114, a potent and selective inhibitor of native and mutated BCR/ABL is active against Philadelphia chromosome-positive (Ph+) leukemias harboring the T315I mutation. Leukemia. 2015 May;29(5):1104−14
Интеллектуальная собственность
Фьюжн Фарма ведет активную международную защиту прав на интеллектуальную собственность. Получены национальные патенты по заявке РСТ/RU2012/000423 с датой приоритета 2012 года. В 2017 г подана новая РСТ заявка PCT/RU2017/050 025 на солевую форму лекарственного препарата с датой приоритета от 2016 года.


